|
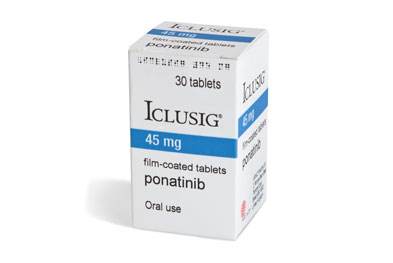
普纳替尼联合化疗治疗新诊断的费城染色体阳性急性淋巴细胞白血病获FDA加速批准,疗效显著但需注意不良反应时间:2024-03-22 2024年3月19日,美国食品和药物管理局(FDA)宣布加速批准普纳替尼(ponatinib,商品名:Iclusig)联合化疗方案,用于治疗新诊断的费城染色体阳性急性淋巴细胞白血病(Ph+ALL)的成年患者。这一决定基于一项名为PhALLCON(NCT03589326)的随机、对照、多中心、开放标签临床试验的结果。
PhALLCON试验共纳入了245名新诊断为Ph+ALL的成年患者,旨在评估普纳替尼联合化疗与另一标准治疗方案(伊马替尼联合化疗)的疗效对比。患者被随机分为两组,其中一组接受每天一次口服普纳替尼30mg联合化疗,另一组则接受每天口服一次伊马替尼600mg联合化疗。化疗方案包括诱导治疗、巩固治疗和维持治疗三个阶段。 试验的主要疗效指标是诱导治疗结束时微小残留病(MRD)阴性完全缓解(CR)率。结果显示,普纳替尼组的MRD阴性CR率为30%,而伊马替尼组为12%。这一显著差异(风险差异0.18[95%CI:0.08,0.28],p值0.0004)表明,普纳替尼联合化疗方案在新诊断的Ph+ALL患者中具有更高的疗效。 然而,需要注意的是,普纳替尼联合化疗方案也伴随着一系列不良反应。最常见的不良反应包括肝功能障碍、关节痛、皮疹及相关病症、头痛、发热、腹痛、便秘、疲劳、恶心、口腔粘膜炎、高血压、胰腺炎/脂肪酶升高、周围神经病变、出血、发热性中性粒细胞减少症、体液潴留和水肿、呕吐、感觉异常和心律失常等。因此,在使用该治疗方案时,医生需要密切监测患者的身体状况,并采取必要的措施来减轻不良反应的影响。 FDA的加速批准是基于该药物在临床试验中表现出的显著疗效,但同时也要求制药公司在药物上市后继续进行研究,以进一步验证其安全性和有效性。这一决定为那些新诊断为Ph+ALL的成年患者提供了新的治疗选择,有望提高他们的生存率和生活质量。然而,患者在使用该药物时,应严格遵循医生的建议,并注意可能出现的不良反应。
海得康”发掘国际新药动态,为国内患者提供全球已上市药品的咨询服务,更多问题,请咨询海得康医学顾问,电话:400-001-9769,海得康官网微信:15600654560。
【友情提示:本文仅作为参考意见。用药期间随时与医生保持联系,随时沟通用药情况。图片侵权,请联系删除。】 |