|
阿特珠单抗TECENTRIQ被FDA批准用于小细胞肺癌一线治疗【海得康海外医疗】时间:2019-03-22 今天我们的主角还是罗氏(Roche)旗下子公司基因泰克(Genentech)的阿特珠单抗(atezolizumab)。即上周获批治疗晚期三阴性乳腺癌后又一振奋人心的好消息。
2019年3月18日,美国食品和药物管理局批准atezolizumab (TECENTRIQ, Genentech Inc.)联合卡铂和依托泊苷用于成人广泛期小细胞肺癌(ES-SCLC)的一线治疗。成功突破小细胞肺癌局限于化疗的僵局,走进小细胞肺癌的免疫治疗时代。
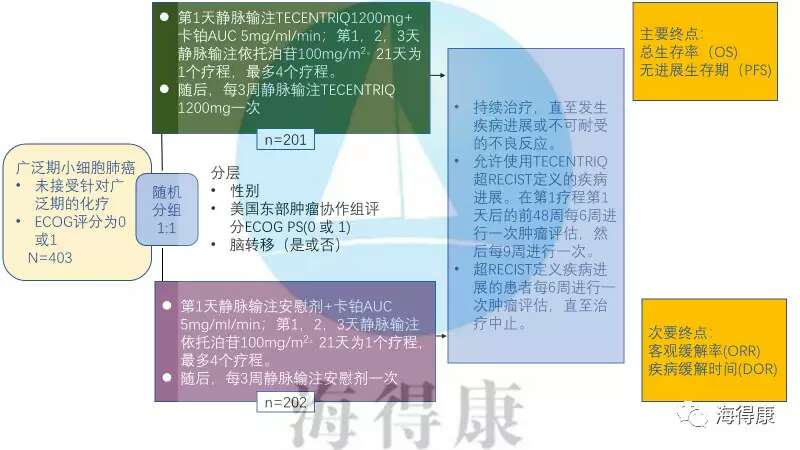
小细胞肺癌(SCLC),有时被称为燕麦细胞癌(oat cell carcinoma)。 分为局限期小细胞肺癌(limited-stage SCLC)和广泛期小细胞肺癌(Extensive Stage SCLC)。大约10%至15%的肺癌是SCLC,其中70%的患者就诊时病变范围广泛,2年生存率为3%。 与非小细胞肺癌相比,小细胞肺癌具有更短的倍增时间,更高的生长分数和更早的转移发展。由于这些特点,临床上20年来治疗研究进展缓慢,还在沿用传统的化疗方案。 阿特珠单抗是第一个批准用于一线治疗广泛期小细胞肺癌的癌症免疫疗法,这种方案已被证明可以提高生存率。阿特珠单抗的获批对广泛期小细胞肺癌的治疗进展有划时代的重大意义。 阿特珠单抗是一种单克隆抗体,设计用于与肿瘤细胞和肿瘤浸润性免疫细胞上表达的PD-L1蛋白结合,阻断其与PD-1和B7.1受体的相互作用。通过抑制PD-L1,TECENTRIQ可以激活T细胞,使这些免疫细胞去击杀癌细胞。 批准的依据是IMpower133 (NCT02763579),这是一项随机(1:1)、多中心、双盲、安慰剂对照III期试验,对403例ES-SCLC患者进行了研究。
这些患者之前没有接受过针对广泛期疾病的化疗,且ECOG表现为0或1。患者被随机分为两组: • 每21天为一个疗程,第一天静脉输注Atezolizumab 1200 mg和卡铂AUC 5 mg/mL/min;第1天、第2天和第3天静脉输注依托泊苷100 mg/m2,最多4个疗程,然后每3周注射一次atezolizumab 1200 mg,直至病情进展或发生不可耐受的毒性; • 安慰剂和卡铂联合应用AUC 5 mg/mL/min(第1天),依托泊苷100 mg/m2(第1天、第2天、第3天),静脉输注,每21天1个疗程,每次最多4个疗程,每3周使用一次安慰剂,直至病情进展或出现不可接受的毒性反应。主要疗效观察指标为总体生存期(OS)和无进展生存期(PFS)。
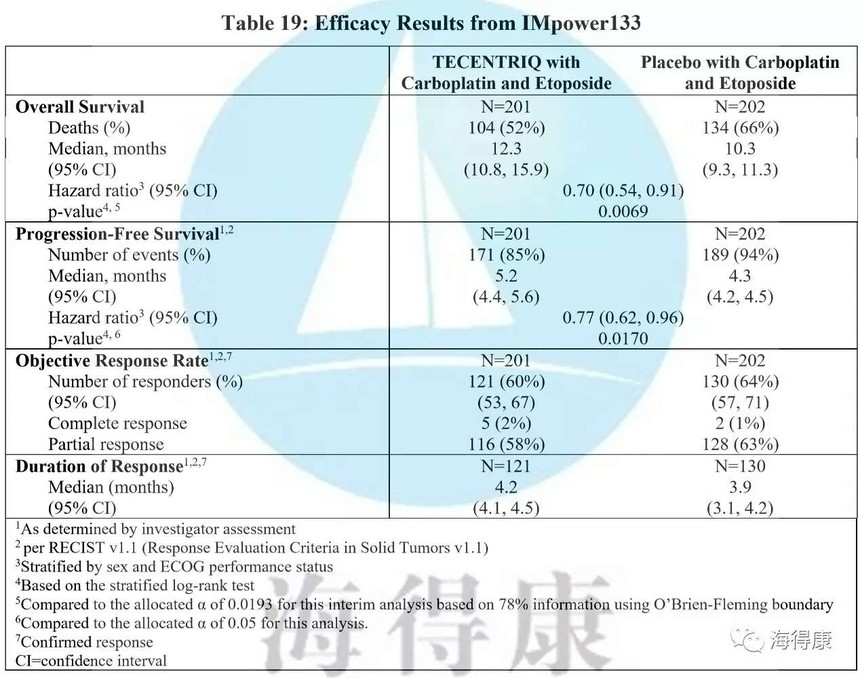
与ITT人群相比,Tecentriq联合化疗显著延长生存时间(中位OS = 12.3对10.3个月; HR = 0.70,95%CI:0.54-0.91; p = 0.0069)。这意味着死亡风险降低了30%,接受atezolizumab治疗的患者1年内存活的可能性更大,1年生存率为51.7%,而对照组为38.2%。
与单独化疗相比,阿特珠单抗联合化疗方案中位无进展生存期(PFS)也有所改善(中位PFS = 5.2对安慰剂组4.3个月; HR = 0.77; 95%CI:0.62-0.96; p = 0.017),显著降低了疾病恶化或死亡的风险。在12个月时,阿特珠单抗组的PFS增加了一倍以上(5.0%对12.6%)
阿特珠单抗联合化疗的安全性似乎与阿特珠单抗的已知安全性特征一致。接受阿特珠单抗联合化疗的患者中有37%发生严重不良反应,而单独接受化疗的患者为35%。 接受阿特珠单抗联合化疗的人群中最常见的不良反应(≥20%):感觉疲劳/虚弱( 39%),恶心(38%),脱发( 37%),食欲下降(27%) ),便秘(26%)和呕吐(20%)。 推荐剂量:阿特珠单抗1200 mg,每3周静脉输注至少60分钟。 当同一天联合化疗药使用时,在给化疗药前给予阿特珠单抗。 如果可以耐受第一次用药,则所有后续静脉输注时间可以减少到30分钟以上。 目前,阿特珠单抗已获批治疗用于既往接受过治疗的转移性非小细胞癌(NSCLC)患者以及不符合顺铂化疗条件或在接受含铂疗法期间或之后出现疾病进展的局部晚期或转移性尿路上皮癌(mUC)患者和成人患者无法切除的局部晚期或转移性三阴性乳腺癌(triple negative breast cancer,TNBC)。
关于阿特珠单抗的临床研究也在如火如荼的进展着。 目前在clinicaltrial注册的共有332项研究。
截至2018年12月,由美国国家癌症研究所(NCI)支持的研究就有112个之多。
期待更多好消息! 海得康是国内知名的出国就医咨询服务公司,帮助中国患者搭建海外医药桥梁!让患者选择更新、更有效、更廉价的治疗药物和方案。海得康医学顾问电话:400-001-9769,微信号:hdk4000019769。
|