|
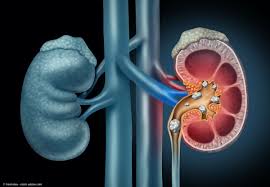
里夫洛萨(Rivfloza)上市了吗?时间:2023-10-12 里夫洛萨(Rivfloza)尚未上市,目前还在临床试验阶段。Rivfloza由Dicerna Pharmaceuticals开发,该公司于2021年被Nordisk收购。根据发布的消息,Nordisk计划在2024年初推出这种药物。 里夫洛萨是一种用于降低1型高草酸尿症(PH1)特定患者尿液草酸盐水平的药物。原发性高草酸尿症1型是一种遗传性疾病,其中草酸盐产生过量,导致尿液中草酸盐过多,从而导致肾结石和慢性肾脏疾病,以及其他并发症。里夫洛萨通过减少参与制造草酸盐的酶(肝乳酸脱氢酶(LDH))来降低草酸盐水平。 患有基因介导疾病的患者可以从里夫洛萨中获益。大多数成石者会形成草酸钙结石,饮食摄入也会产生一些草酸盐。里夫洛萨是一种注射剂,有80 mg、128 mg或160 mg剂量,每月皮下注射一次。研究人员指出,它作为核糖核酸干扰(RNAi)疗法,旨在降低尿草酸盐水平。 患有[原发性高草酸尿症(PH)]的人在肝脏的三种蛋白质中有一种蛋白质异常,导致过量的草酸盐合成,肾脏是无辜的旁观者,结果导致肾结石和肾衰竭。Rivfloza适用于PH1患者。
批准是在第二阶段临床试验PHYOX2的结果和正在进行的第三阶段扩展研究PHYOX3的中期结果之后。在PHYOX2试验中,与安慰剂组相比,用Rivfloza治疗的患者经历了从第90天到180 mg的24小时尿草酸盐排泄的显著减少。报道的最常见的不良反应是注射部位反应,发生在超过20%的患者中。PHYOX3扩展的中期结果表明,接受Rivfloza额外6个月治疗的13名PH1患者的24小时尿草酸盐排泄量持续减少。 FDA对里夫洛萨的批准建立在诺和诺德推进研究、促进创新和建立战略合作伙伴关系以扩大罕见疾病治疗选择的传统基础上,研究者致力于代表罕见疾病患者推动变革,并帮助解决PH1社区尚未满足的重大需求。期待着第一个RNAi治疗能够为PH1患者和医疗提供服务。 关于该药物是否会将草酸盐排泄恢复到标准水平,其相当一部分患者的24小时草酸盐排泄正常。任何减少都是有意义的,并且可能与慢性肾病进展较慢和结石较少相关。 对于这类疾病长期的问题将是降低草酸盐的排泄是否会减少慢性肾病的进展。最终,避免肝脏和肾脏移植将是理想的目标。 按照临床试验提供的数据显示,PH1 (39%)患者的轻度注射部位反应为皮肤发红、疼痛、青紫和皮疹。里夫洛萨一般是每月注射一次,剂量是基于实际体重。医生根据患者的体重计算出所需剂量。 在动物生殖研究中,当使用里夫洛萨时,未观察到不利的发育影响。里夫洛萨对兔子或小鼠没有药理活性。在兔子中观察到的胚胎-胎儿毒性尚不清楚。
“海得康”发掘国际新药动态,为国内患者提供全球已上市药品的咨询服务,请咨询海得康医学顾问:400-001-9769,海得康官网微信:15600654560。
【友情提示:本文医药信息内容仅供参考,具体疾病治疗和用药请咨询医生评估,海得康不承担任何责任。本站图片来源于网络,侵权请联系删除。】
|