|
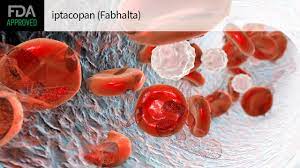
Fabhalta(iptacopan)的出现成为治疗血液疾病的重磅炸弹时间:2023-12-15 诺华公司表示,对C3肾小球疾病(C3G)患者第三期研究正在进行。患者使用六个月后,与安慰剂相比,Fabhalta在蛋白尿(尿液中的蛋白质)方面提供了具有临床意义和统计显著性的减少。 C3G是一种罕见的补体介导的肾脏疾病,诺华公司希望通过Fabhalta来解决。在诊断后的10年内,大约50%的C3G患者出现肾衰竭。没有针对C3G潜在原因的治疗方法。 食品和药物管理局签署完毕这是首个用于治疗阵发性睡眠性血红蛋白尿症(PNH)的口服单药疗法。 在APPEAR-C3G中,患者接受背景治疗,实验组每天服用两次200 mg剂量的Fabhalta。诺华表示,该试验达到了其主要终点,安全性符合之前对Fabhalta的研究。
该研究将持续6个多月,所有患者接受Fabhalta治疗,包括服用安慰剂的患者。在这个开放标签期间,12个月时蛋白尿的减少将是主要终点。还将测量12个月与6个月的蛋白尿减少的比较。 次要终点包括估计肾小球滤过率(eGFR)的变化、符合复合肾终点标准的参与者比例、肾小球炎症的变化和患者报告的疲劳的变化。 因为C3G经常袭击年轻人,诺华公司也在一项单独的研究中招募青少年患者。 Fabhalta于2023年12月6日获得FDA批准,作为治疗成人阵发性夜间血红蛋白尿症的首个口服单一疗法。Fabhalta的作用机制是它与选择性补体途径的因子B结合,从而防止血管内(在血管中)溶血和血管外(主要在肝脏和脾脏中)溶血。
“海得康”发掘国际新药动态,为国内患者提供全球已上市药品的咨询服务,请咨询海得康医学顾问:400-001-9769,海得康官网微信:15600654560。
【友情提示:本文医药信息内容仅供参考,具体疾病治疗和用药请咨询医生评估,海得康不承担任何责任。本站图片来源于网络,侵权请联系删除。】 |