|
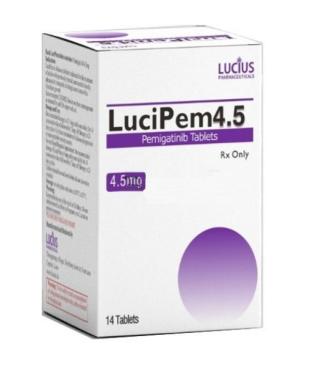
佩米替尼的全球获批情况:从美国FDA到中国NMPA的历程,仿制药上市了吗时间:2025-04-07 佩米替尼(Pemigatinib),一款针对FGFR2融合或重排的口服小分子酪氨酸激酶抑制剂,自其研发以来便备受瞩目。这款药物在全球范围内的获批历程,见证了从科学研究到临床应用的艰辛与成就。
一、美国FDA的批准 2020年4月17日,美国食品药品监督管理局(FDA)加速批准了佩米替尼(商品名Pemazyre)用于治疗存在FGFR2基因融合或重排的晚期或转移性胆管癌。这是全球首个胆管癌靶向药物获批的重要里程碑。FDA授予佩米替尼“突破性疗法”和“孤儿药”的资格,以表彰其在胆管癌治疗领域的创新性和重要性。 临床试验数据显示,佩米替尼在存在FGFR2融合或重排的胆管癌患者中展现出了显著的疗效。中位治疗时间达9.1个月,总体缓解率为36%。这些数据为佩米替尼的获批提供了坚实的临床依据。 二、中国NMPA的批准 2022年4月6日,中国国家药品监督管理局(NMPA)正式批准佩米替尼(上市品牌名为“佩美曲伦片”)用于治疗既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者。这一批准标志着佩米替尼正式进入中国市场,为中国的胆管癌患者带来了新的治疗选择。 在中国的多中心临床试验中,佩米替尼同样展现出了显著的疗效。治疗存在FGFR2基因异常的胆管癌患者时,其客观缓解率达50%,疾病控制率100%。这些数据进一步验证了佩米替尼在中国患者中的疗效和安全性。 三、全球范围内的获批情况 除了美国FDA和中国NMPA外,佩米替尼还相继在日本、欧盟、加拿大、澳大利亚等多个国家和地区获批上市。这些批准不仅扩大了佩米替尼的市场覆盖范围,也证明了其在全球范围内的疗效和安全性得到了广泛认可。 四、研发历程与未来展望 佩米替尼的研发历程充满了挑战与机遇。从最初的科学研究到临床试验的开展,再到最终的获批上市,每一步都凝聚了科研人员和医疗专业人士的智慧和汗水。未来,随着临床研究的不断深入和药物的不断优化,相信佩米替尼将为更多胆管癌患者带来希望和福音。 同时,佩米替尼的成功也为我们提供了宝贵的经验。在肿瘤治疗领域,精准医疗和靶向治疗正逐渐成为主流趋势。通过基因检测和分子分型等手段,我们可以更准确地识别患者的靶点信息,从而制定更加个体化的治疗方案。这不仅可以提高治疗效果,减少不必要的副作用,也可以为患者带来更好的生存质量和预后。
佩米替尼仿制药已在老挝上市,仿制药是一种治病的新选择,如需购买,可自行出国就医, “海得康”作为一个专业的医疗咨询平台,为患者提供有关该药物的详细信息和个性化建议。海得康有着丰富的国际新药动态知识和经验,能够为国内患者提供全球已上市药品的专业咨询服务。如有需要,可以拨打服务热线400-001-9769或海得康官方微信15600654560来获取帮助。请注意,所有关于药物的使用和副作用的信息都应仅作为参考,并不应替代医生的专业建议。在决定使用或更改任何药物治疗方案之前,务必与医生进行充分的沟通和讨论。
|