更多资讯
|
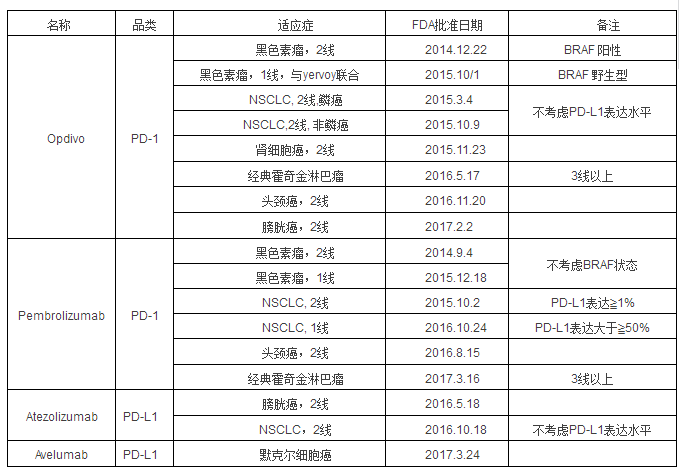
免疫抑制剂PD-L1和TMB检测现状及未来发展方向时间:2017-07-03 针对免疫逃逸的多种肿瘤免疫治疗正在研发中,免疫治疗有多个环节,远远复杂于靶向治疗。细胞免疫从抗原的释放、捕捉、递呈和加工,以及到T细胞攻击等,各个环节出现问题,都可能导致免疫逃逸。免疫治疗最大的进展在于免疫检查点,肿瘤免疫中,检查点是负性调节,可以使免疫细胞对肿瘤细胞视而不见。免疫治疗的前提是肿瘤具有高免疫原性,NSCLC的免疫原性非常好,因此PD-1、PD-L1抑制剂在2015年快速发展。 2016年8月,BMS对外宣布了名为“CheckMate 026”的三期临床试验的核心数据,在PD-L1表达>5%的NSCLC患者中,Opdivo相比化疗,PFS(无进展生存期,4.2对5.9个月)和OS(总生存期,14.4对13.2个月)都没有显著提高。反观默沙东公司的同类药物Keytruda,在以PD-L1表达>50%的NSCLC患者作为入组指标的名为“Keynote024”的临床试验中,ORR、PFS甚至OS均完胜,拿下NSCLC一线适应症。因此,BMS股票市值一度跌了20%,BMS的损失成就了竞争对手的市值增长。BMS公司以惨痛的代价教育后来者,PD-L1表达>5%不是一个好的指标。 据AACR2017大会最新报告,研究人员采用TMB(肿瘤突变负荷)作为标志物对CheckMate026三期临床试验进行回顾性研究,结果显示,相比PD-L1,选择TMB作为Opdivo治疗NSCLC的biomarker,能更好地区分获益人群。该研究发现,在TMB高表达的病人中,采用Opdivo进行治疗后,ORR(客观缓解率47%vs. 28%)和PFS(无进展生存期,9.7月vs.5.8月)结果显著优于化疗,这一结果为BMS公司的Opdivo药物作为NSCLC一线用药带来新希望。可以预见,未来将有更多药企会考虑将TMB纳入ICIs药物临床试验的检测范围。 精准医学始于靶向治疗,免疫治疗一开始就思考能否利用靶向治疗的成功之路。在过去,NSCLC只是一种类型的疾病,人们是基于组织学进行化疗和生物制剂的选择。现在,根据肿瘤生物学特征,基于分子分型,进行个体化的精准靶向治疗。 现在,有人提出免疫治疗2.0时代,即免疫治疗从过去比较粗放的治疗,到现在基于免疫检查点的单克隆抗体阻断治疗,这比过去有了巨大的飞跃和进步。基于PD-1/PD-L1抑制剂的免疫检查点还有很多需要探索,包括CD8+T细胞亚群的检测是否与疗效、预后相关。研究发现,在其他肿瘤中肿瘤突变负荷与疗效、预后相关。 1、PD-L1 首先我们先了解一下什么是PD-L1,PD-L1是一种表达于细胞表面的蛋白,又称B7-H1蛋白,是由CD274基因编辑表达。它可以与效应T细胞上的PD-1及B7.1结合,传导免疫抑制信号,抑制免疫效应T细胞的活性。PD-L1在许多类型的细胞中表达,包括胎盘、血管内皮细胞、胰岛细胞、肌肉、肝细胞、上皮细胞、间充质干细胞,以及B细胞,T细胞,树突状细胞,巨噬细胞,肥大细胞。而PD-L1在肿瘤细胞表面的表达则成为了肿瘤逃脱免疫细胞追杀造成肿瘤生长的驱动因素。 PD-L1在肿瘤细胞的表达机制有两种,组成性广泛(固有)表达和适应性聚焦表达。固有表达是因为致癌基因信号通路改变引起的PD-L1的组成性表达,表达恒定。适应性聚焦表达是在免疫细胞分泌的促炎症因子如IFN-γ的作用下表达,是动态变化的。这两种表达机制不排斥,PD-L1的固有表达可在炎症因子作用下表达上调。 基于以上机理, PD-L1的检测是基于细胞蛋白水平的检测,因此临床试验中以免疫组化方法为主。也就是大家在手术或穿刺后取得的肿瘤组织进行切片染色,通常在病理报告中显示。免疫组化是检测蛋白表达的经典手法,其通过抗体着色后由病理医师镜下观察根据着色深浅来评价表达情况。因此除了染色技术外,抗体的特异性也尤其重要。而目前我国PD-L1检测比较混乱,一是染色技术及条件的不统一;二是染色的抗体多样;三是病理评价标准尚未统一。这些都导致国内患者检测PD-L1的价值减低。 早期研究显示,PD-L1的表达与PD-L1/PD-1抑制剂的疗效相关,随着PD-L1表达升高疗效增加,疾病控制时间延长,而且预后改善。 1.1 PD-L1检测的临床价值 截至到目前,FDA已经批准了4款PD-1/PD-L1抑制剂用于7类不同肿瘤的治疗,下表列出批准的时间和基本适应症(精准适应症全称请查阅FDA官方网站)。
名称品类适应症FDA批准日期备注 目前市场上这四种单抗检测是否具有可比性,是否可以通用?检测技术是IHC,一种仪器是Ventana,一种是Dako,而且评价细胞有肿瘤细胞和肿瘤浸润免疫细胞,因此在评价免疫治疗时要考虑单抗药物、检测方法、cutoff值等信息。现在,50%高表达仅限于默沙东的检测方法,至于是否与其他方法通用,目前缺乏循证医学证据。 罗氏单抗药物是Atezolizumab,靶点PD-L1,PD-L1 ICH检测使用Ventana SP142,评价的细胞是肿瘤细胞和肿瘤浸润免疫细胞,cutoff值定为1%、5%、50%。III期OAK研究显示,PD-L1高表达人群倾向于从Atezolizumab治疗中获得更大的OS获益,而且随着表达率的增高,获益更大;在PD-L1阴性亚组中,Atezolizumab相比多西他赛未能提高ORR。 施贵宝的Nivolumab靶点PD-1,检测使用Dako28-8,cutoff值是1%、5%。III期CheckMate057研究显示,PD-L1的表达水平与非鳞NSCLC患者从Nivolumab治疗的OS获益呈正相关。III期CheckMate017研究显示,Nivolumab在鳞癌患者中的疗效与PD-L1的表达水平无关。 第三个是Pembrolizumab单抗,靶点PD-1,PD-L1IHC检测使用Dako 22C3,评价的是肿瘤细胞,cutoff值是1%、50%。III期KEYNOTE010研究显示,PD-L1高表达人群接受Pembrolizumab治疗后死亡风险下降更多。PD-L1表达对Pembrolizumab至关重要,PD-L1强阳性的患者甚至可以一线使用。 1.2 如何定义表达率 PD-L1检测受人诟病的地方之一是缺乏标准。已经获批或正在研究中的抗PD-1治疗,包括atezolizumab和durvalumab都有自己配套的PD-L1检测。但问题是,每种检测所用到的抗体和具体技术都不同,导致PD-L1阳性的定义只对应于药企自己的标准。比如虽然所有的检测都分析了肿瘤细胞的PD-L1染色情况,但atezolizumab同时需要评估免疫浸润细胞的PD-L1状态。针对检测标准的问题,包括国际肺癌研究协会在内的多个国际组织都在努力推进不同PD-L1表达检测技术分析,以期能够提供不同检测间可靠的精密度对比数据。 在临床试验中, Keytruda及opdivo定义了PD-L1表达的统计标准,主要以百分比为标尺,即在至少有100个肿瘤细胞的癌巢中,表达PD-L1的肿瘤细胞占癌巢肿瘤细胞的比例,因此出现了PD-L1表达的百分比之说。下图即是PD-L1表达量1%、1%-49%、50%的不同镜下图,黄色为着色部位即表达PD-L1的细胞。(ABC为低倍镜下,DEF为高倍镜下)。 而atezolizumab治疗NSCLC的临床试验中,他们将检测点不只局限在肿瘤细胞的PD-L1表达上还同时评价了肿瘤环境中浸润的免疫细胞上PD-L1的表达情况,即采用了TC及IC两个标准,试验结束,两个预测指标对疗效都有独立预测价值。这主要基于体内的免疫细胞如调节T细胞也参与了免疫环境的调控。这也提示PD-L1的检测存在很多分歧事宜。 1.3 PD-L1检测的问题与挑战 PD-L1检测存在的问题有:生物学方面,如瘤间及瘤内异质性,干预治疗影响表达,以及细胞类型、染色部位等;检测技术方面,如不同的检测抗体和平台,不同的阈值;组织来源方面,组织类型,原发部位与转移灶,细胞学标本,标本质量等。这些可能会干扰PD-L1的检测结果,需要大量临床研究进行证实。 美国AACR、IASLC和4家公司联合制定了蓝印计划,目的就是比对四种单抗的检测结果。蓝印计划在39个NSCLC标本比较4个试剂检测的结果,在染色方面,28-8、22C3、SP263显示出相似的肿瘤细胞阳性染色百分比,SP142染色阳性的肿瘤细胞较少;4种试剂在免疫细胞的染色上一致性较大;在临床诊断方面,4种试剂完全一致的只占19%。 德国的一致性研究显示,4种试剂在肿瘤细胞染色之间的一致性较高,免疫细胞色一致性较差。 AZ比较研究对500例标本比较了28-8、SP263和22C3的肿瘤细胞染色,结果显示3种试剂之间的一致性较高。 2016年ESMO报告了迄今最大样本量的NSCLC PD-L1检测数据,包括4784例NSCLC,研究得出4项结论:鳞癌和腺癌的表达分布相似;经治和初治人群的表达分布相似;原发部位和转移灶的表达分布相似;新鲜标本和存档标本的表达分布相似。 FDA获批的PD-1/PD-L1抑制剂对PD-L1的检测要求,对于不同肿瘤根据不同的循证医学证据批准,如Nivolumab二线治疗无需PD-L1表达检测,但建议补充诊断,Atezolizumab二线治疗也不需要PD-L1表达检测,Pembrolizumab一线治疗PD-L1≥50%,二线治疗≥1%。 2肿瘤突变负荷 从已经批准的适应症和关键临床研究提供的证据来看,PD-L1的表达是否可以指导临床用药,选择获益人群,结论目前还不一致,这从另外一个侧面提示PD-L1表达还不是一个完美的bio-marker。研究较多的潜在bio-marker 有肿瘤突变负荷(tumor mutation burden, TMB)、微卫星高度不稳定(microsatelliteinstability-high, MSI-H)和错配基因修复缺失(mismatch-repair deficiency,MMR),这些潜在的bio-marker又指向一个共同点突变相关新抗原(mutation-associated neoantigen)。抗CTLA-4在恶性黑色素瘤的研究与抗PD-1在NSCLC的研究进一步说明识别突变相关新抗原是引起自身抗肿瘤免疫反应的核心要素。 2.1背景知识 肿瘤突变负荷(TMB)涉及到两个重要概念germline mutation(种系突变或胚系突变)和somatic mutation(体细胞突变),来自BioNinjia的图解一目了然地诠释二者的关系与区别。胚系突变来自上一代,可以遗传,比如血友病,镰刀细胞贫血等。 图片出处Somatic vs Germline Mutations Somatic突变为获得性突变,在诱变剂的影响下发生突变,可表现在RNA和蛋白水平,产生的新抗原(或新表位)、蛋白片段、肽段等被自身免疫系统识别为非自我(non-self)抗原,激活T细胞,引起免疫反应。 体细胞突变可能受到外源性诱变因素的影响,比如肺癌中烟草(吸烟)诱导的C→A的突变。恶性黑色素瘤中,紫外线照射引起的C→T的突变。内源性因素引起的突变可以是DNA错配修复突变,比如结直肠癌和食管癌中的MSI(微卫星不稳定)。在实体肿瘤中,95%的突变为单个碱基的替换,造成的非同义突变(一个核苷酸突变改变一个蛋白的氨基酸顺序),错义突变(非同义点突变,单个核苷酸改变导致一个密码子编码一个不同的氨基酸)和无义突变(非同义点突变使一个密码子变为终止密码子引起多肽链合成提前终止),共同构成了体细胞非同义突变的基本要素。 2.2 TMB定义: 全基因组中计入胚系DNA变体后体细胞突变数目。比如Lawrence,MS团队在Nature上发表的研究中,将超过100个突变/Mb称之为高TMB。 2.3 临床研究 Tumor Mutation Burden 指导临床研究并已经取得的成果,突变负荷越高,治疗应答越好,有时肿瘤类型更复杂、肿瘤突变负荷更高的癌症患者治疗应答会更好,这听起来可能有点不可思议。 抗PD1和抗程序性死亡配体(PD-L1)检查点抑制剂可能有助于激活高肿瘤突变负荷癌症患者的免疫系统,如果你体内存在大量肿瘤新抗原,一旦重新激活你的免疫系统,它就有东西可抗击。 在初始验证和验证组(共65名患者),对比治疗无响应的患者,对治疗有响应的患者都具有较高的突变负荷。此外,高突变负荷组对比中、低突变负荷组,在客观反应率、无进展生存期和总生存期中均较高。 免疫疗法应答表 肿瘤突变负荷免疫疗法应答率(%) 低4 中等26 高45 非常高67 2.4 TMB成为bio-marker的优点与局限 TMB可以横跨多个肿瘤进行横向分析;可潜在甄别具体的突变模式和推测新抗原负荷;高覆盖特点可以检测出罕见的体细胞突变;高通量分析可以为已知驱动突变(比如,EGFR,ALK,ROS1等);TMB可以量化;可以用于选择IO治疗高获益人群。 TMB分析技术要求高和时间密集;NGS(如全外显子组测序)价格昂贵,医保挑战;数据复杂需要生物信息学专家解读;面临的NGS技术挑战有,石蜡包埋组织DNA/RNA降解;TMB需要有更多的临床证据说明与免疫检查点抑制剂疗效之间的关系;TMB作为潜在的bio-marker,cut off需要定义。 总而言之,TMB是潜在的预测IO疗效的bio-marker;NGS(next generation sequencing)可以用于检测TMB(选项有全基因组测序、全外显子组测序和选择性基因测序);高TMB已经被证明与CTLA-4抑制剂治疗黑色素瘤和PD-1/PD-L1抑制剂治疗黑色素瘤、膀胱癌和NSCLC的临床疗效相关;TMB作为潜在IO biomarker的临床研究正在进行中,需要探索与PD-L1表达和肿瘤免疫微环境因素之间的关系。 2.5 如何检测肿瘤突变负荷 TMB(肿瘤突变负荷)是一项新兴的诊断方式,可以帮助预测免疫治疗在某些肿瘤中的响应,例如肺癌、膀胱癌和黑色素瘤。 美国Foundation和范德宝大学的合作者已经公布了使用TMB的最新数据支持,作为foundation one全面的基因组分析的一部分,是全球唯一可以帮助预测PD-1/L1的治疗效果的检测。这项结果将会添加到以往的证据中,来表明患者可以通过TMB预测免疫治疗的获益程度,这也让我们更加接近让最多的患者能从免疫治疗中受益的目标,为临床医生判定患者是否适合使用PD-1/PD-L1提供依据。 目前,很多临床研究都显示,TMB可以预测免疫治疗的疗效,如Nivomulab,Pembrolizumab和Atezolizumab。但这些临床试验中采用不同的检测平台进行TMB检测,且高TMB的cut-off值也各不相同。今后需要前瞻性的在临床研究以及临床实践中,探索和研究最佳的检测方法和cut-off值。此外,PD-L1表达目前也是比较成熟的免疫预测指标。TMB与PD-L1如何更好的联合应用,从而筛选最佳的免疫治疗获益人群,也是未来需要探索的重点。 肿瘤的微环境非常复杂,涉及到肿瘤细胞、肿瘤微血管、免疫细胞以及肿瘤间质等,他们之间的关系都需要进行明确的相关性研究,未来需要基于肿瘤微环境免疫特征的生物标记物研究。 海得康发掘国际新药动态,为国内患者提供全球已上市药品的咨询服务,如丙肝新药印度吉三代、肝癌新药印度多吉美、PD-1、PD-L1、肺癌AZD9291等,帮助国内患者选择更新更有效的治疗药物和手段,更多药品信息及购药渠道,详询:400-001-9763,010-67385800,微信:headkonhdk 。 |
|
|